昆明动物所发现GSNOR可作为NLRP3炎症小体相关疾病的潜在治疗靶点
NLRP3炎症小体由胞内固有免疫受体NLRP3、接头蛋白ASC和蛋白酶caspase-1(半胱氨酸天冬氨酸蛋白酶1)组成,形成了一个多蛋白复合物。当该复合物组装完成时,能够在巨噬细胞中引发促炎因子白细胞介素1 β(IL-1β)和白细胞介素18(IL-18)的成熟和分泌,从而诱导炎症反应的发生。NLRP3炎症小体的活化,与多种人类重大疾病的发生密切相关。NLRP3蛋白表达水平在炎症小体激活中起着关键作用,因此其在体内的表达,受到严格调控,以维持免疫稳态并避免异常活化带来的有害影响。目前,NLRP3蛋白调控是个研究热点,现有研究多集中在转录后水平和翻译后修饰水平,关于NLRP3转录激活的调控机制仍然不明确。
中国科学院昆明动物研究所研究员姚永刚团队重点关注S-亚硝基谷胱甘肽还原酶(GSNOR)在病毒感染与神经退行性疾病中的作用。GSNOR由ADH5基因编码,是乙醇脱氢酶(ADH)家族中的成员。前人研究发现,生物体内的GSNOR能调控多种蛋白的S-亚硝基化,参与多种生理和病理过程。研究发现,GSNOR在抗病毒天然免疫和帕金森病中发挥作用,分别通过调控重要靶蛋白TBK1和CDK5的亚硝基化水平,进而影响下游信号通路,影响疾病的发生发展过程。研究过程中,研究团队意外发现GSNOR能够在转录水平上调控NLRP3和IL-1β表达,进而从分子、细胞和小鼠模型等多个层次,开展了系统的研究。研究发现,GSNOR通过调控MAPK14蛋白亚硝基化修饰,影响NLRP3和IL-1β 的mRNA转录,进而调控NLRP3炎症小体活性。在两种小鼠炎性模型中,GSNOR缺失会加重疾病的进程,敲除NLRP3或者药物抑制MAPK14,可以缓解由于GSNOR缺失引起的NLRP3炎症小体激活,进而缓解炎性疾病的进程。该研究深化了对NLRP3表达调控的认识,同时提示GSNOR可通过降低MAPK14蛋白亚硝基化修饰,进而抑制其活性,并在转录水平上调控NLRP3和IL-1β表达,可作为NLRP3炎症小体相关疾病的潜在治疗靶点。
近期,以上研究以GSNOR negatively regulates the NLRP3 inflammasome via S-nitrosation of MAPK14为题发表于Cellular and Molecular Immunology。副研究员刘前进为文章的第一作者,姚永刚与刘前进为文章的共同通讯作者。
该研究得到国家自然科学基金委、云南省和中国科学院基金项目的资助。
论文全文链接: https://www.nature.com/articles/s41423-024-01155-9
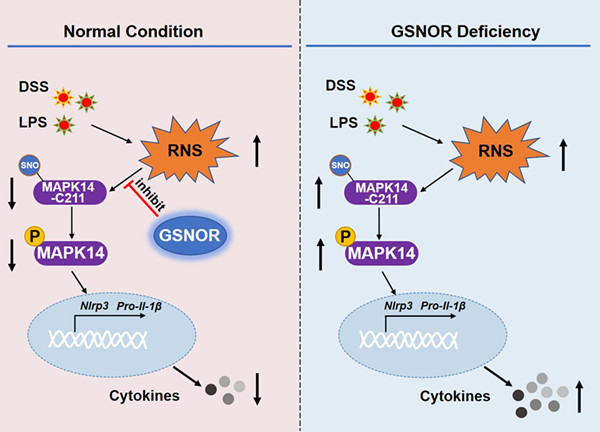
图1. GSNOR通过调控MAPK14蛋白亚硝基化修饰,影响NLRP3和IL-1β 的转录,进而调控NLRP3炎症小体介导的炎症反应
